Hiện nay, Viện Bảo vệ thực vật là một trong số các cơ sở nghiên cứu của Bộ NN-PTNT có khả năng sản xuất được các cây giống sạch bệnh trong nhà lưới, trong đó bao gồm cây có múi và chanh leo.
Theo TS Nguyễn Thị Bích Ngọc, Phó Viện trưởng Viện Bảo vệ thực vật, cây ăn quả đòi hỏi thời gian sinh trưởng dài, đầu tư lớn. Vì vậy nếu cây giống không sạch bệnh thì sẽ gây thiệt hại lớn cho nông dân, cả về thời gian lẫn tài chính.
"Để có được những vùng nguyên liệu khỏe mạnh, bền vững còn phụ thuộc vào quy trình canh tác của bà con. Tuy nhiên, yếu tố đầu tiên là phải có cây giống chất lượng và sạch bệnh trước khi đưa ra đồng ruộng", TS Ngọc chia sẻ và nhấn mạnh thêm, với cây ăn quả có múi, greening vẫn là bệnh nguy hiểm nhất, không thể chữa.
Giám định thường xuyên
Theo quy trình, hệ thống nhà lưới sẽ là nơi lưu giữ cây S0 được tạo ra bằng kĩ thuật ghép đỉnh sinh trưởng, chồi ghép được khai thác từ cây đầu dòng. Ở công đoạn tiếp theo, nhà lưới lưu giữ cây S1 cung cấp mắt ghép sạch bệnh phục vụ nhân giống và cuối cùng là nhà lưới sản xuất cây giống sạch bệnh S2.
Tuy nhiên, để đảm bảo nguồn bệnh không xâm nhập, lây lan trong những cây giống này, các cơ sở nghiên cứu, sản xuất phải thường xuyên thực hiện công tác giám định. Với mô hình hoạt động của Viện Bảo vệ thực vật, TS Nguyễn Thị Bích Ngọc cho biết, những cây đầu dòng sẽ được giám định bằng phương pháp xét nghiệm sinh học phân tử - PCR.
"Cây đầu dòng là những cây tốt nhất, được chọn lọc từ nhiều nơi và lưu giữ trong môi trường cách ly với các nguồn bệnh tiềm tàng", TS Ngọc nói. Tuy nhiên, để chắc chắn về sức khỏe của cây, cần thực hiện các xét nghiệm giám định định kỳ, trong đó có phương pháp PCR. Đây là phương án xét nghiệm có tỷ lệ chính xác lên đến 99% và có thể phát hiện ra vi khuẩn khi mật độ còn thấp. Tuy nhiên, hạn chế của phương pháp này là phải thực hiện trong phòng thí nghiệm với những thiết bị chuyên dụng như máy PCR và cán bộ có chuyên môn cao.
Ngoài ra, giám định PCR cũng đòi hỏi chi phí cao và thời gian dài trong còng 24 tiếng mới có kết quả. Do đó, ở Viện Bảo vệ thực vật, PCR chỉ dành cho những cây đầu dòng quan trọng và cần lưu giữ tốt.

Cán bộ Viện Bảo vệ thực vật thao tác xét nghiệm trên máy PCR. Ảnh: Tùng Đinh.
Trong những công đoạn sản xuất cây giống tiếp theo, phương pháp giám định bệnh greening thường được sử dụng là bộ kit dạng màng. Đây là phương pháp có giá thành rẻ hơn PCR, thời gian cho kết quả cũng ngắn hơn, thường trong vòng 8 – 10h.
Tuy nhiên, yêu cầu đối với người thực hiện giám định cũng phải có chuyên môn cao và hệ thống thiết bị, máy móc hỗ trợ như trong phòng thí nghiệm. Ngoài ra, tỷ lệ chính xác của phương pháp này cũng thấp hơn PCR một chút, vào khoảng 90%.
Theo các chuyên gia của Viện Bảo vệ thực vật, kit dạng màng và quy trình chẩn đoán bệnh greening bằng kit dạng màng là kết quả nghiên cứu của dự án "Hoàn thiện quy trình công nghệ tổng hợp để tái canh cây cam hiệu quả cao tại một số tỉnh phía Bắc".
Trong đó, nguyên lý kỹ thuật của phương pháp này là phản ứng đặc hiệu giữa kháng thể với kháng nguyên đặc hiệu xuất hiện trong dịch mô cây bệnh và được cố định trên màng nitrocellulose.
Bên cạnh những điểm mạnh và hạn chế đã nêu trên, kit dạng màng được đánh giá cao nhờ khả năng thực hiện trên số lượng mẫu lớn và phát hiện bệnh sớm hơn so với kit Iodine. Do đó, TS Nguyễn Thị Bích Ngọc cho biết, phương pháp này thường được sử dụng trên cây giống S2, trước khi đưa ra ruộng đồng.
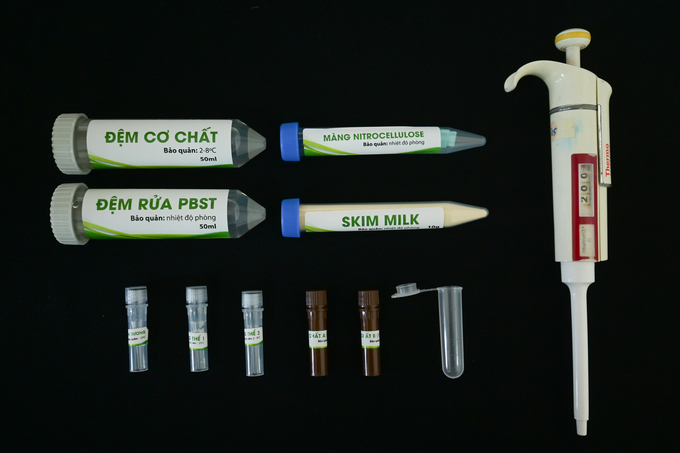
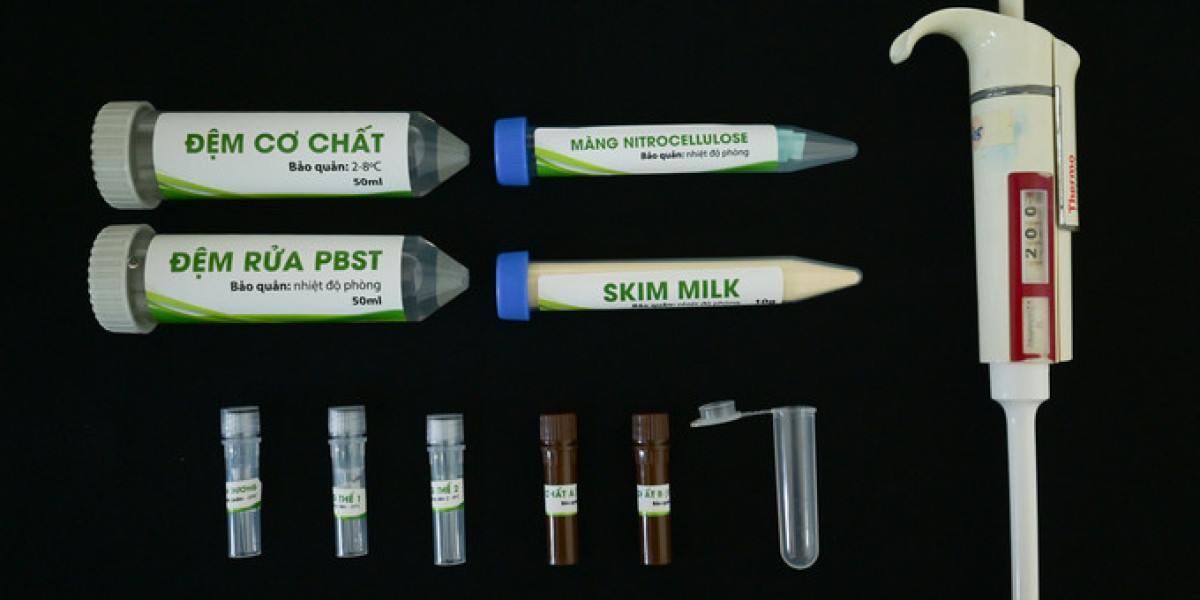
Cận cảnh các dụng cụ bên trong bộ kit dạng mạng để giám định bệnh greening trên cây có múi. Ảnh: Tùng Đinh.
Quy trình chẩn đoán bệnh greening bằng kit dạng màng
Bước 1: Chuẩn bị màng nitrocellulose
- Dùng kéo sạch để cắt màng nitrocellulose theo kích thước cần sử dụng. Chia các ô và đánh dấu bằng bút chì thứ tự các vị trí sẽ nhỏ mẫu trên màng. Mỗi ô kích thước khoảng 0,5 x 0,5cm tương ứng cho 1 mẫu. Giữ miếng màng đã chuẩn bị trong đĩa petri sạch có nắp đậy, bảo quản nhiệt độ phòng
Bước 2: Chuẩn bị và nghiền mẫu
- Mẫu tươi hoặc mẫu được bảo quản lạnh (tối đa 7 ngày) được tách gân lá. Cắt nhỏ 0,1g gân lá cho vào chày cối sứ vô trùng. Có thể sử dụng nitơ lỏng nghiền mẫu thành bột mịn sau đó bổ sung đệm coating buffer tỷ lệ 1:10 (ví dụ 0,1g mẫu cần 1ml dung dịch đệm) hoặc nghiền trực tiếp trong đệm coating buffer theo tỷ lệ trên. Chuyển toàn bộ dịch nghiền sang ống Eppendorf 1,5ml và để trên đá 20 – 30 phút để phần dịch trong nổi nên trên.
Bước 3: Cố định mẫu
- Nhỏ 1 – 1,5 µl phần dịch nổi phía trên của mỗi mẫu lên các ô trên màng nitrocellulose đã chuẩn bị, mỗi mẫu nhỏ 2 lần, để dịch khô trong 15 phút ở nhiệt độ phòng. Rửa màng bằng PBST trong 30 phút.
Bước 4: Khóa màng
- Chuẩn bị dung dịch khóa màng (PBST + 5% skim milk).
- Màng sau khi cố định mẫu được đặt vào dung dịch khóa màng, thực hiện trên máy lắc gia nhiệt ở 37⁰C trong 60 phút.

Những mẫu nhiễm bệnh (6 cột bên trái) có màu tím và những mẫu sạch bệnh (2 cột bên phải) có màu trắng. Ảnh: Tùng Đinh.
Bước 5: Ủ kháng thể sơ cấp (kháng thể 1)
- Chuẩn bị dung dịch pha kháng thể sơ cấp: PBST + 5% skim milk + 1,5% bột gân lá cây có múi khỏe (gân lá cây khỏe được nghiền với chày cối sứ vô trùng trong nito lỏng sau đó thêm dung dịch khóa màng đã chuẩn bị ở bước khóa màng hoặc nghiền trực tiếp trong dung dịch khóa màng với tỷ lệ 1,5%). Pha và ủ kháng thể sơ cấp (polyclonal rabbit IgG đặc hiệu SDE1) trong dung dịch đã chuẩn bị với tỷ lệ 1:5000 trong 50 phút trước khi chuyển màng.
- Chuyển màng và ủ trong dung dịch 60 phút trong máy lắc ở nhiệt độ 37⁰C. Kháng thể sơ cấp sẽ gắn đặc hiệu tại các vị trí protein kháng nguyên đã được cố định trên màng. Rửa màng bằng PBST 3 lần, 10 phút/lần.
Chú ý: Màng luôn được ngâm trong PBST cho đến khi được ủ với kháng thể sơ cấp.
Bước 6: Ủ kháng thể thứ cấp (kháng thể 2)
- Chuẩn bị dung dịch pha kháng thể thứ cấp: PBST + 1% skim milk. Kháng thể thứ cấp được pha với đệm tỷ lệ 1/20.000dd.
- Chuyển màng và ủ trong dung dịch 60 phút trong máy lắc ở nhiệt độ 37⁰C. Kháng thể thứ cấp (kháng thể 2) sẽ gắn với kháng thể 1 tại các vị trí cố định trên màng. Rửa màng bằng PBST 3 lần, 3 phút/lần.
Chú ý: Màng luôn được ngâm trong PBST cho đến khi được ủ với kháng thể sơ cấp.
Bước 7: Phản ứng hiện màu với cơ chất và đọc kết quả
- Pha đệm cơ chất: NBT 66 µg/mL, BCIP 33 µg/mL, Tris 1,0 M; NaCl 1,0 M; MgCl2 0,05 M; NaN3 0,2%; pH 9,5.
- Chuyển màng sang dung dịch cơ chất, ủ ở nhiệt độ phòng trong điều kiện tránh ánh sáng. Ủ đến khi các vị trí nhỏ mẫu chuyển sang màu tím (tối đa 30 phút).
- Đọc kết quả:
+ Mẫu dương tính được xác định khi các vị trí nhỏ mẫu chuyển màu tím
+ Mẫu âm tính được xác định khi các vị trí nhỏ mẫu có màu xanh nhạt.